Обратимся теперь к свойствам воды и рассмотрим ее с точки зрения основных наук — физики, химии и др.[ ...]
Молекула воды Н20 имеет форму тупоугольного треугольника (рис. Г), с углом между двумя связями кислород-водород примерно 104°. Электроны водородных атомов отгануш к кислороду, так что «водородные углы» треугольника несут избыток положительного заряда, а «кислородный угол» — отрицательного. В результате «водородные углы» одной молекулы взаимодействуют с «кислородными углами» других молекул, и такая химическая связь (она называется водородной) объединяет молекулы воды в своеобразный пространственный полимер. Иными словами, хотя вода — жидкость, ее молекулы находятся не в хаотическом состоянии, а образуют некое подобие правильной структуры (что, вообще говоря, свойственно лишь кристаллам).[ ...]
Коснусь еще нескольких общеизвестных, но очень важных свойств воды. Как упоминалось выше, существует три изотопа водорода: водород Н (или протай), устойчивый дейтерий О и радиоактивный тритий Т. Кроме того, в природе существует три изотопа кислорода. В результате различных комбинаций изотопов водорода с изотопами кислорода можно получить 42 различных вида воды. Наиболее знакомые нам — обычная вода Н20 и так называемые тяжелая (дейтериевая) 020 и сверхтя-желая (тритиевая) Т20 вода. На Земле тритий присутствует в ничтожных количествах, а вот дейтерия довольно много — один атом О на 6700 атомов Н, и это означает; что тяжелой воды в обычной весьма заметное количество — 150—160 г/т С этим наш организм еще справляется, но вообще тяжелая вода для нас не слишком полезна.[ ...]
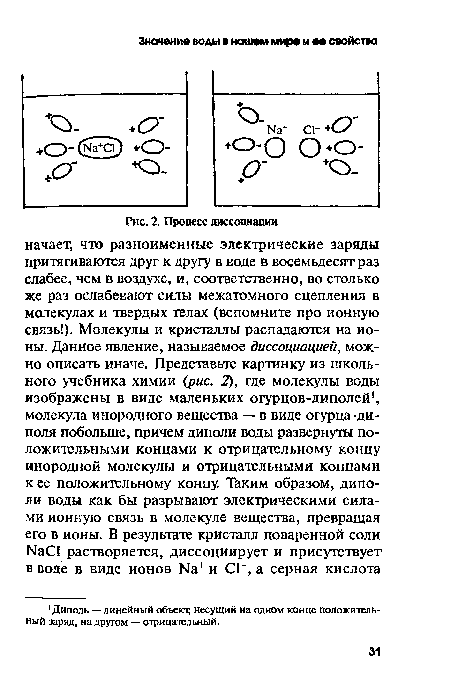
Н2804 распадается на катион водорода Н+ и анион кислотного остатка 802 . Молекулы воды тоже диссоциируют на ионы Н+ и ОН", но в очень слабой степени.[ ...]
Почему нам так важно разобраться с описанным выше явлением и запомнить, что множество веществ, растворяясь в воде, преобразуются в ионы? Потому, что способность ионов вступать в химические и биохимические реакции гораздо выше, чем у молекул. Молекулы электронейтральны, а ионы несут положительный или отрицательный заряд. Отличаясь большой активностью, они не упустят возможности отдать лишний или присоединить недостающий электрон. Вода является изолятором, но раствор соли или кислоты в воде — это электролит, который отлично проводит электрический ток. В этом легко убедиться, опустив в раствор электроды и подав на них напряжение. Наша питьевая вода с точки зрения физики и химии не что иное, как слабый электролит, в котором концентрация солей не должна превышать 1 г/л.[ ...]
В силу своей способности ослаблять межатомные и межмолекулярные связи вода является великим разрушителем, способным растворить что угодно: одни вещества — соль, сахар, всевозможные газы — со зримой быстротой, другие — металлы, твердые горные породы — более медленно, незаметно для глаза, но неотвратимо. Поэтому, например, не может быть идеальной дистиллированной воды — попав в сосуд, она тут же начинает растворять его стенки, и среди молекул Н20 появляется ничтожная примесь инородных молекул материала сосуда.[ ...]
В заключение напомню еще об одном замечательном свойстве воды. Если расплавить любое твердое тело, то его объем увеличится, а это означает; что плотность всех твердых тел больше плотности соответствующих жидкостей, то есть они тонут в своих расплавах. У воды же все наоборот! При охлаждении и превращении в твердую фазу объем воды увеличивается, а плотность уменьшается — то есть лед не тонет, а плавает в воде. В противном случае, если бы лед тонул, все наши водоемы промерзали бы зимой до самого дна и были бы безжизненными. В том числе и Ледовитый океан, который являлся бы такой же многокилометровой толщей льдов, как Антарктида.[ ...]
Рисунки к данной главе:
| Процесс диссоциации |
 |