В молекуле воды ядра водорода и кислорода образуют равнобедренный треугольник, в основании которого находятся два мелких ядра водорода, в вершине — более крупное ядро кислорода. Валентный угол у центрального атома кислорода, образованный связями Н — О — Н, составляет 104°27 (рис. 1.1, а). Структура электронного облака молекулы схематично показана на рис. 1.1, 6. Две внешние пары электронов, образующих связи О — Н, смещенУ к атому кислорода, поэтому вблизи ядер атомов водорода создается избыток положительного заряда. Две не поделенные пары электронов также смещены относительно ядра атома кислорода, и их отрицательные заряды остаются частично не скомпенсированными. Условно можно представить, что лепестки электронного облака направлены к вершинам частично искаженного тетраэдра, что иллюстрируется рис. 1.1, в.[ ...]
Асимметричность распределения электрических зарядов обусловливает ярко выраженные полярные свойства молекулы воды, которая представляет собой диполь с очень высоким электрическим моментом.[ ...]
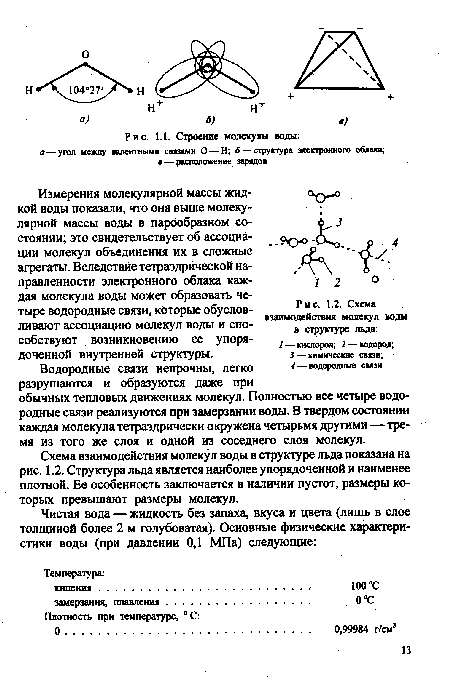
Измерения молекулярной массы жидкой воды показали, что онг выше молекулярной массы воды в парообразном состоянии; это свидетельствует об ассоциации молекул объединения их в сложные агрегаты. Вследствие тетраэдрической направленности электронного облака каждая молекула воды может образовать четыре водородные связи, которые обусловливают ассоциацию молекул воды и способствуют возникновению ее упорядоченной внутренней структуры.[ ...]
Водородные связи непрочны, легко разрушаются и образуются даже при обычных тепловых движениях молекул. Полностью все четыре водородные связи реализуются при замерзании воды. В твердом состоянии каждая молекула тетраэдрически окружена четырьмя другими — тремя из того же слоя и одной из соседнего слоя молекул.[ ...]
Схема взаимодействия молекул воды в структуре льда показана на рис. 1.2. Структура льда является наиболее упорядоченной и наименее плотной. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул.[ ...]
По сравнению с другими химическими соединениями вода обнаруживает необычные отклонения по ряду физических свойств — плотности, удельной теплоемкости и др. Эти аномалии воды в значительной степени связаны с ассоциацией ее молекул.[ ...]
Уникальным свойством воды является ее способность при обычных температурах и давлении находиться в трех агрегатных состояниях: твердом (лед), жидком и газообразном (пар).[ ...]
Повышение температуры воды действует двояко: вызывает нарушение регулярной структуры и приводит к тепловому расширению. В интервале температур от 0 до 4 °С (плавление льда) происходит разрушение части водородных связей, т. е. нарушается структура льда, достигается более плотная упаковка молекул в результате размещения отдельных молекул воды в пустотах оставшихся агрегатов. В этом интервале температур фактор нарушения структуры преобладает над тепловым расширением, и плотность воды повышается, достигая максимального значения при 3,98 °С. При 3,98 °С оба фактора взаимно уравновешиваются. Дальнейшее нагревание воды до 100 °С сопровождается нормальным снижением плотности, так как преобладает действие теплового расширения. Эта аномалия обусловливает возможность жизни в водоемах, замерзающих в зимнее время. Поскольку лед легче воды (его плотность меньше), он располагается на поверхности и защищает лежащие ниже слои воды от промерзания. Пр дальнейшем понижении температуры увеличивается толщина слоя льда, но температура воды подо льдом остается на уровне 4 °С, что позволяет водным организмам сохранять жизнь.[ ...]
Большое значение в жизни природы имеет также и тот факт, что вода обладает аномально высокой теплоемкостью — 4,18 Дж/(гК). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на Земле.[ ...]
Рисунки к данной главе:
| Схема взаимодействия молекул воды в структуре льда |
 |