Константа скорости мономолекулярной реакции имеет размерность, обратную времени, [£,] = [г ], чаще всего она выражается в обратных секундах (с ). Константа k2 имеет размерность, обратную размерности произведения концентрации на время. Если концентрация выражалась в моль/см , а время в секундах, то константа скорости k2будет выражена в смя/(моль • с).[ ...]
В научной литературе встречаются разные способы выражения концентраций и, соответственно, констант скоростей реакций второго и третьего порядка. В Приложении 2 приведены переводные коэффициенты для основных из них.[ ...]
Входящая в показатель степени константа Е называется энергией активации реакции и имеет размерность энергии (Дж/моль). Молекулы вступают в реакцию, только если их энергия равна Е или превышает ее. Таким образом, энергия активации - это избыток энергии, который необходим молекулам реагентов (в сравнении со средней энергией молекул данной среды, например, газа) для прохождения реакции. Активация молекул осуществляется благодаря бимолекулярным столкновениям, которые тем чаще, чем выше температура.[ ...]
Спектры поглощения молекул образованы сериями линий, соответствующих изменениям энергии при переходе электронов на более высокие энергетические уровни. При определенной длине волны X линейчатый спектр превращается в сплошной (в сторону уменьшения X). Эта граница соответствует энергии, достаточной для разрыва связи. Например, энергия диссоциации связи N—О в молекуле М02 равна 300,8 кДж/моль, что соответствует поглощению света с длиной волны, равной или короче 397,7 нм. Однако при комнатной температуре фотолиз N02 протекает (на 36 %) даже при облучении светом с длиной волны 404,7 нм. Это происходит благодаря тому, что при отличных от 0 К температурах молекулы газа находятся в состоянии колебательно-вращательного (теплового) возбуждения, т. е. имеется термический вклад в фотодиссоциацию, понижающий ее энергию.[ ...]
Размерность коэффициента фотодиссоциации [Г1], как и у константы скорости мономолекулярной реакции.[ ...]
Квантовый выход может быть не только меньше единицы, но и значительно превосходить ее, достигая многих сотен. Это относится к цепным реакциям. Такие реакции состоят из последовательных элементарных процессов, и только первый из них является собственно фотохимическим. Образовавшиеся при фотодиссоциации свободные радикалы реагируют с другими молекулами, причем возникают новые радикалы, пока не произойдет их рекомбинация в устойчивые молекулы, например за счет столкновения с аэрозольными частицами или с другими радикалами.[ ...]
А + В » АОО + ВОО — - Продукты.[ ...]
Считается, что фрагментация муравьиной кислоты с образованием устойчивых продуктов (Н2 и С02) не играет значительной роли. В условиях нижней атмосферы сильную конкуренцию прямому фотоокислению создают процессы с участием реакционноспособных кислородсодержащих частиц.[ ...]
Этот же процесс ответственен за образование 02( Дв) в верхних и средних слоях тропосферы, в которые проникает солнечная радиация с длиной волны менее 310 нм.[ ...]
В качестве переносчиков энергии могут выступать ароматические углеводороды (бензол, нафталин и др.) и их производные. Кроме того установлено, что полиядерные ароматические соединения, адсорбированные на поверхности частиц силикагеля, оксидов алюминия и магния, способны передавать энергию возбужденного состояния молекулам 02 с образованием синглетного кислорода. Это говорит об участии 02(‘Дв) в гетерогенном фото-стимулированном окислении адсорбированных на поверхности частиц природного аэрозоля соединений.[ ...]
Рисунки к данной главе:
| Меридиональное распределение N0 в тропосфере в июле 1984 г. |
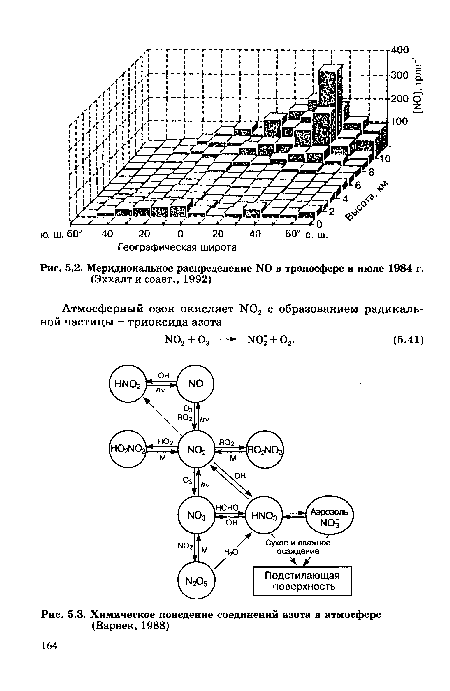 |
| Химическое поведение соединений азота в атмосфере |
 |