Ровс = 1.293 кг/м3 -плотность смеси принята по воздуху.[ ...]
Пример 3. Определить порядок реакции и рассчитать скорость окисления цианидов гипохлоритом натрия при разных pH, если исходная концентрация цианид-иона 300 мг/л.[ ...]
Первая реакция протекает настолько быстро, что трудно удается измерить ее скорость. Лимитирующей стадией является реакция гидролиза цианхлора, скорость которой зависит от pH. Так как эта реакция протекает при избытке щелочи и гипохлорита, согласно уравнению реакции, скорость должна описываться уравнением второго порядка.[ ...]
Подставив- в уравнения значения концентрации цианхлора, соответствующие 30, 60 и 80 минутам, например, при pH = 6,3, получены нижеследующие показатели (табл. 8.1).[ ...]
Вторая реакция протекает значительно медленнее, чем первая, и с большим избытком озона по отношению к теоретическому (4,3 г озона на 1 г цианита против теоретического 1,72 г при pH =3,7).[ ...]
В течение 60 мин окисляется (гидролизуется) порядка 20 % ци-анатов1.[ ...]
Волоцков Ф. П. Очистка и использование сточных вод гальванических производств. - М.: Стройиздат, 1983. - С. 20. (Рис. 6).[ ...]
Пример 5. Рассчитать продолжительность реакции осаждения двухвалентного железа Ре+г едким натрием (щелочью), если содержание железа в исходной и очищенной воде соответственно С0 = 5 г/л и Сисх =10 мг/л. Объемная скорость подачи сырья 1м3/ч.[ ...]
Принимая значения концентрации железа по графику "кинетики реакции осаждения железа едким натрием" для т = 20 с, вычисляется константа скорости (см. график, рис. 8.2).[ ...]
Рисунки к данной главе:
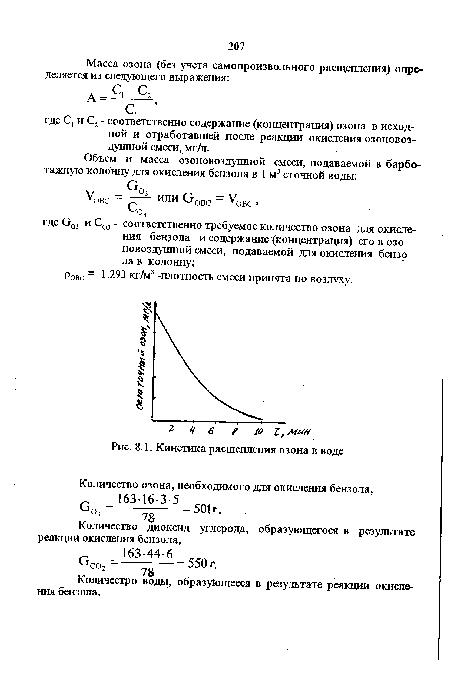
| Кинетика расщепления озона в воде |
 |
| Кинетика реакции осаждения едким натрием |
 |
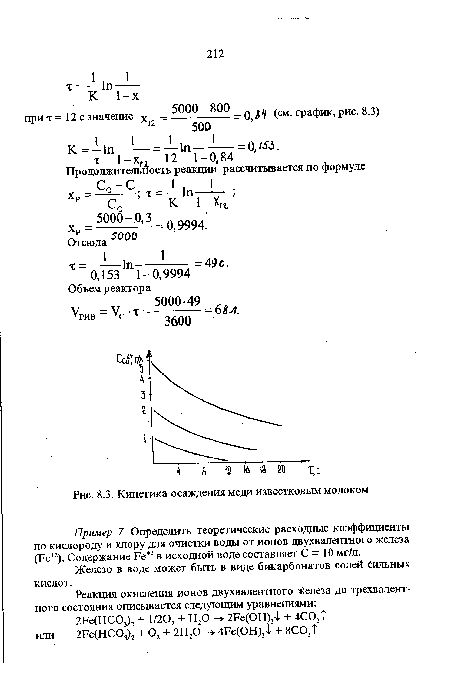
| Кинетика осаждения меди известковым молоком |
 |
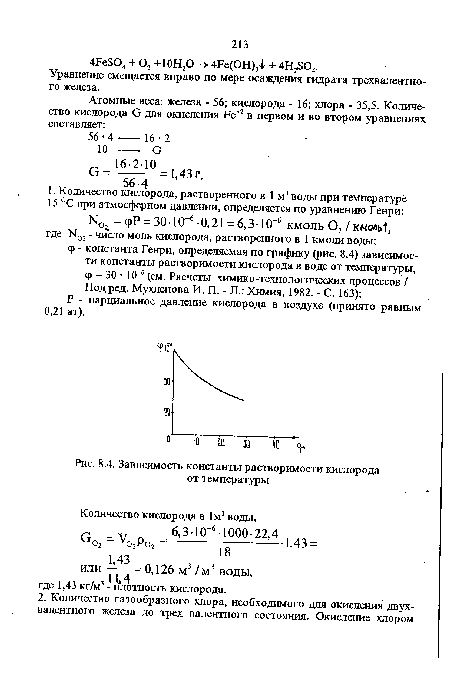
| Зависимость константы растворимости кислорода от температуры |
 |
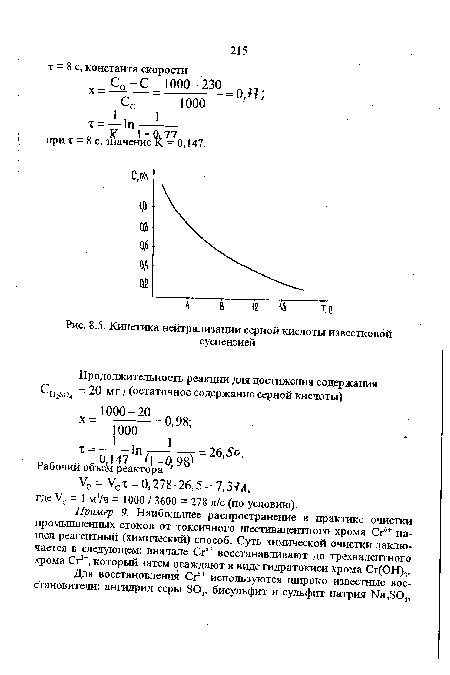
| Кинетика нейтрализации серной кислоты известковой |
 |
| Кинетика восстановления бихромата калия сульфитом натрия (pH = 4) |
 |