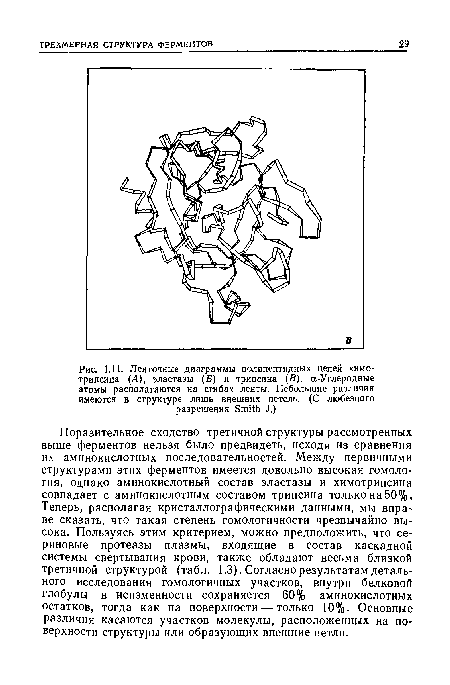
Поразительное сходство третичной структуры рассмотренных выше ферментов нельзя было предвидеть, исходя из сравнения их аминокислотных последовательностей. Между первичными структурами этих ферментов имеется довольно высокая гомология, однако аминокислотный состав эластазы и химотрипсина совпадает с аминокислотным составом трипсина только на 50%, Теперь, располагая кристаллографическими данными, мы вправе сказать, что такая степень гомологичности чрезвычайно вы сока. Пользуясь этим критерием, можно предположить, что се-риновые протеазы плазмы, входящие в состав каскадной системы свертывания крови, также обладают весьма близкой третичной структурой (табл. 1.3). Согласно результатам детального исследования гомологичных участков, внутри белковой глобулы в неизменности сохраняется 60% аминокислотных остатков, тогда как на поверхности — только 10%- Основные различия касаются участков молекулы, расположенных на поверхности структуры или образующих внешние петли.
Скачать страницу
[Выходные данные]