Гидроксид алюминия выпадает в осадок при pH = 4,0—12,5, а гидроксид железа — при pH > 3 (Ре3+) и pH > 9 (Ре2+). Одновременно в воде присутствуют перечисленные выше соединения. При pH < рНоптим эти соединения относятся, как правило, к катионному типу ,а при pH > рНоптим — к анионному. При значениях pH, близких к оптимальным, в воде присутствуют, в- основном, А1(ОН)з и Ре(ОН)з. Другие соединения содержатся в воде в незначительных количествах.[ ...]
Анионные ПАВ, многие красители, а также смеси неионогенных ПАВ с многими прямыми и кислотными красителями сорбируются хлопьями гидроксидов алюминия и железа, образующимися при введении в сточную воду соответствующих коагулянтов. Средняя эффективность очистки сточных вод от ПАВ коагулянтами — 80% . Неионогенные ПАВ в отсутствие анионных ПАВ и красителей коагулянтами не удаляются.[ ...]
Поскольку гидроксиды и сульфиды тяжелых металлов образуют устойчивые коллоидные системы для интенсификации процесса их осаждения в сточные воды необходимо вводить коагулянты и флокулянты. Коллоидные частицы сульфидов имеют отрицательный заряд, поэтому для коагуляции сульфидов используют электролиты с многозарядными катионами — обычно сульфаты алюминия или трехвалентного железа. При коагуляции гидроксидов требуется электролит с многозарядными анионами, так как коллоидные частицы заряжены положительно. Хорошими коагулянтами гидроксидов являются сульфат-ионы. Помимо электролитной коагуляции на практике часто используют взаимную коагуляцию коллоидных растворов с противоположным зарядом частиц.[ ...]
| Влияние анионного состава воды на кинетику коагуляции гидроксидов алюминия и железа, образующихся при гидролизе их хлоридов (а) и сульфатов (б). |  |
При определении анионов (цианид-, йодид-, нитрат-, сульфид- и роданид-ионы) в виде летучих органических производных их экстрагировали из воды раствором пентафторбензилбромида в метиленхлориде и анализировали полученный раствор фторпроизводных с ЭЗД на насадочной колонке с силиконом при программировании температуры в интервале 140—220"С [48]. Для обнаружения нитритов в природных водах [49] к 150 мл воды добавляли раствор, содержащий сульфат цинка, гидроксид натрия, серную кислоту и йодид калия в гексане. Определению могут мешать лишь очень большие количества сульфит-, сульфат- и хлорат-ионов.[ ...]
При формировании гидроксидов металлов последние образуют аквакомплексы типа [А1(Н20)3- (ОН)3], [А1(Н20)5-0Н]2+ит. п. за счет ступенчатого отщепления протонов от молекул воды. При этом происходит полимеризация гидроксокомплексов с образованием многозарядного полимеризованного иона типа А12(ОН)5 А14(ОН)4+, А17(ОН) + А113(ОН)!+ Ре3(ОН)45+ и др. [7]. Для катионов А13+ и Ре3+ характерна сильная тенденция к образованию соединений не только с ионами гидроксила, но и с другими анионами и группами: фосфатными, сульфатными, карбоксильными и др. Так, предполагается наряду с формированием А1(0Н)504, А12(0Н)504 образование соединений типа [А1(Н20)50Н]804, А16(ОН)12, (804)з, [А1Р207], [РеНР04]+. Аналогичные соединения образуют и другие металлы.[ ...]
Коллоидные частицы гидроксидов и оксисолей, выделяющихся при гидролизе солей-коагулянтов, в нейтральной и слабокислой средах вследствие сорбции катионов водорода и алюминия или железа имеют положительный заряд. Поэтому на кинетику процесса их коагуляции большое влияние оказывает анионный состав среды.[ ...]
Реакция протекает между анионом соли и водой. Так как образующаяся уксусная кислота — соединение малодиссоциированное, то равновесие диссоциации воды нарушается и в растворе оказывается избыток гидроксид-ионов. Реакция среды растворов солей такого типа будет щелочной.[ ...]
Более быстрое образование гидроксидов и их осаждение при добавлении хлоридов алюминия и железа наблюдается в двойных смесях с анионами НСОз" и С1 , а более медленное — с анионами НСО;Г и БО2-. При большом содержании хлоридов и малой щелочности в дисперсионной среде хлопья гидроксидов алюминия не образуются. Высокие значения pH раствора и ионы хлора оказывают сенсибилизирующее, а при низких — стабилизирующее влияние на коагуляцию гидроксидов. При добавлении сульфатов алюминия и железа скорость процесса образования хлопьев и их осаждения зависит от pH среды. Катионы натрия, кальция, магния меньше влияют на процесс коагуляции. Наличие большого количества сульфат-ионов в случае применения в качестве коагулянта алюмината натрия [47] значительно расширяет оптимальную для коагуляции зону значений pH (рис. 1.14).[ ...]
| Схема взаимодействия гидроксидов с катионами и анионами. | 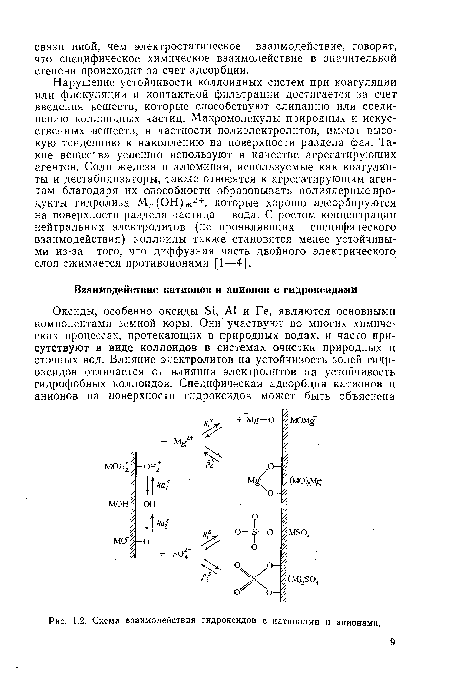 |
Коагуляция коллоидных частиц гидроксидов алюминия и железа вызывается анионами (сульфатами, гидрокарбонатами, хлоридами), содержащимися в обрабатываемой воде. Коагуляция идет-с наибольшей скоростью при следующих пороговых концентрациях анионов (г-экв/л): С1 0,07; НСО3 0,005; SO 0,001—0,002. В природных водах концентрации этих ионов обычно меньше и поэтому скорость коагуляции ниже.[ ...]
Флокулянты, как катионного, так и анионного типа оказались малоэффективными при вакуум-фильтровании осадков водопроводных станций, содержащих гидроксиды алюминия и железа. Неудовлетворительные результаты: высокая влажность кека и низкая производительность вакуум-фильтра, наблюдались и при обезвоживании смеси канализационных и водопроводных осадков.[ ...]
Проводят регенерацию анионита раствором гидроксида натрия в условиях, аналогичных описанным в предыдущем определении (норма удельного расхода гидроксида натрия на 1 г-экв поглощаемых анионов должна быть равной 200 г). Отмывку регенерирующего раствора заканчивают при щелочности промывной воды, не превышающей 0,2 мг-экв/л по фенолфталеину. В условиях, аналогичных описанным в предыдущем определении, пропускают через регенерированный анионит раствор хлорида натрия. Циклы ионного обмена заканчивают при снижении щелочности фильтрата на 0,7 мг-экв/л по сравнению с концентрацией NaCl в исходном растворе.[ ...]
Рассматриваемые нами комплексы (металлов с анионами сильных кислот) малопрочны и сильно диссоциируют (распадаются) с образованием ионов определяемого металла. Эти ноны металла при больших pH образуют с гидроксид-ионами основные соли или гидроксиды, обычно выпадающие в осадок. Это приводит к разрушению окрашенного комплекса.[ ...]
Неорганические иониты в зависимости от pH раствора часто обменивают одновременно и катионы, и анионы, т.е. возможна молекулярная сорбция электролитов. Из этого класса веществ широко известен гидроалюмосиликат натрия пермутит №20-А120з-ЗЮ2 2Н20. Его применяют для умягчения воды за счет обменной реакции ионов натрия пермутита с ионами кальция воды.[ ...]
Реакция проходит в щелочной среде, где возможно образование гидроксидов ряда металлов, с которыми может соосаждаться медь. Поэтому используется раствор диэтилдитиокарбамата свинца в хлористом углероде (СС14). Образовавшийся комплекс меди растворяют в хлороформе, в присутствии анионов лимонной кислоты. При этом гидроксиды железа, цинка, марганца и другие остаются в водной фазе.[ ...]
| Изотерма адсорбции препарата «Новость», содержащего анионное ПАВ (алкилсульфат натрия), на гидроксидах алюминия и железа |  |
Поэтому получение окрашенного комплекса рассматриваемого иона с анионом слабой кислоты следует проводить при высоких значениях pH раствора. Однако нужно остерегаться резкого увеличения pH раствора вследствие возможности побочных процессов, ухудшающих колориметрическое определение: образования осадков гидроксидов или основных солей определяемого катиона.[ ...]
Полярографиропанию поддаются практически все катионы металлов, многие анионы, неорганические и органические вещества, способные к .электрохимическому окислению или восстановлению. Чувствительность метода велика, что позволяет определять миллионные доли граммов вещества в I см3 исследуемого раствора [270[. В частности, метод используют для определения органических и неорганических веществ в воздухе, находящихся в различных агрегатных состояниях. После отбора пробы воздуха вещества переводят в раствор, требуемый по методике, с целью его последующего анализа на приборе. В качестве фона — основного электролита для переноса электрического тока через электролизер (ячейку) — применяют соли и основания одновалентных металлов, кислоты и др. Для определения щелочных металлов, обладающих отрицательным потенциалом восстановления, применяют гидроксид гетраметиламмония или его галоидные соли, для определения органических веществ рекомендуют применять соли лития, тетрзметиламмоыия и различные буферные растворы.[ ...]
Для простоты изложения будем принимать, что в щелочной среде образуется анион метаалюминиевой кислоты А10 . Метаалюминат натрия как соль, образованная слабой кислотой и сильным основанием, подвергается гидролизу: АЮГ +2Н2О А1(ОН)3+ОН-. На этом свойстве и основано использование его в качестве коагулянта. Минимальная растворимость гидроксида алюминия наблюдается в интервале значений pH 6,5—7,5.[ ...]
Вторая ступень обессоливания воды предназначается для обмена катионов и анионов, оставшихся после обработки воды на фильтрах 1-й ступени. Регенерация Н-катионитового фильтра 2-й ступени осуществляется серной или соляной кислотами. Перед подачей воды на анионитовый фильтр 2-й ступени производится удаление свободной угольной кислоты физическими методами. Это необходимо потому, что при обескремнивании воды на сильноосновном анио-нитовом фильтре 2-й ступени идет поглощение угольной кислоты. Это уменьшает обменную емкость фильтра по кремниевой кислоте и увеличивает расход регенерирующего раствора. Обескремнивание воды производится на фильтре, загруженном сильноосновным анионитом АВ-17. Здесь же происходит удаление оставшихся анионов дольной кислоты. Регенерация этого фильтра производится раствором гидроксида натрия.[ ...]
При исследовании электролитной коагуляции на разбавленных диализованных золях гидроксидов алюминия и железа выявлено, что максимальная скорость коагуляции обусловливается такими пороговыми концентрациями ионов в растворе: С1- — 0,07 н.; ОН"—0,1—0,3н.; НСО — 0,005н.; БО -— 0,001—0,002 н. Поскольку в природных водах концентрация анионов обычно ниже этих величин, то коагуляция гидроксидов протекает с меньшей скоростью.[ ...]
Алюминат натрия МаА102. Его получают при взаимодействии едкого натра с оксидом или гидроксидом алюминия. Содержание водорастворимого алюминия в пересчете на оксид алюминия в техническом продукте составляет 55%- Растворимость при 20° составляет 370 г/л. Раствор имеет щелочную реакцию среды (pH 9), поэтому для создания условий образования гидроксида алюминия необходимо связывать избыток щелочности. При водоочистке алюминат натрия используется, если увеличение солесодержания за счет анионов коагулянтов является нежелательным.[ ...]
Гидролиз вводимых коагулянтов заканчивается очень быстро, в течение одной-двух минут. Гидроксиды алюминия или железа вследствие большого разбавления образуют коллоидные растворы. Золи гидроксидов металлов имеют положительный заряд вследствие адсорбции катионов металла, образующего гидроксид, на коллоидной частице. Противоионами являются анионы соли металла (сульфат-, хлорид-ионы).[ ...]
При обработке стоков известью ликвидируется бикарбонат-ная жесткость, ионы магния осаждаются в виде гидроксида, а ионы кальция в виде карбоната кальция. Для удаления ионов кальция, связанных с анионами сильных кислот, сточные воды обрабатывают содой. Кроме того, снижению образования накипи способствует зернистая присадка, вводимая в испарительный контур: В качестве такой присадки рекомендуется бытовой мел (ТУ 573-005—70) с частицами размером до 70 мкм в количестве 8—15 кг на 1 м3 упариваемого стока.[ ...]
Образование осадков [5.24, 5.55, 5.64]. Очистка сточных вод данным методом заключается в связывании катиона или аниона, подлежащего удалению, в труднорастворимые или слабодиссоции-рованные соединения. Выбор реагента для извлечения аниона, условия проведения процесса зависят от вида соединений, их концентрации и свойств. Очистка сточных вод от ионов цинка, хрома, меди, кадмия, свинца в соответствии с санитарными нормами возможна при получении гидроксидов этих металлов. Более глубокая очистка воды от иона цинка достигается при получении сульфида цинка. Очистка от ионов ртути, мышьяка,- железа также возможна в виде сульфидов ртути, мышьяка и железа. Использование в качестве реагента солей кальция позволяет провести очистку сточных вод от цинк- и фосфорсодержащих соединений. В результате очистки получается суспензия, содержащая труднорастворимые соли, отделение которых возможно методами отстаивания, фильтрации и центрифугирования.[ ...]
Следует учитывать, что в кислой среде возможно образование дихромата из хромата, а в щелочной - образование гидроксида серебра. Кроме того, различные анионы, присутствующие в вытяжке, и прежде всего С032 могут образовывать труднорастворимые осадки с ионом серебра.[ ...]
Схема включает, помимо собственно гидролиза, три реакции: 1) нейтрализацию катионов водорода (Н+ + НСОз); 2) формирование гидроксид-бикарбонатных соединений алюминия [А1(ОН)п - -+ НСОз]; 3) образование основных солей алюминия с другими анионами воды [А1(ОН)э + А-]. Для определенных условий очистки воды в системе этих реакций существует свое динамическое равновесие.[ ...]
Коагулирование воды — это сложный физико-химический процесс, включающий в себя три стадии: 1) образование коллоидного раствора гидроксида металла в результате полного гидролиза коагулянта; 2) коагуляцию образовавшегося золя коагулянта под действием анионов воды и его взаимодействие с коллоидными и грубодисперсными примесями воды; 3) процесс хлопьеобразования, завершающийся седиментацией. В процессе обработки воды необходимо поддерживать оптимальные условия для каждой стадии процесса.[ ...]
Оптимальная температура прокаливания устанавливалась в зависимости от величины pH водной вытяжки из прокаленного пигмента. Осадок в процессе его образования и кристаллизации сорбирует на себе не только катионы тяжелых металлов и их гидроксиды, но и различные анионы, например 50 , присутствующие в сточной воде либо вводимые в осадок при его модифици ровании вместе с суспензией зародышей. При прокаливании осадка происходит образование и удаление из системы 802, вследствие чего pH водной вытяжки пигмента увеличивается, и таким образом этот показатель входит в диапазон требований ТУ (табл. 51).[ ...]
К сожалению, общих теоретических предпосылок по применению флоку-лянтов пока нет. В определенных случаях, зная заряд частиц загрязнителя, можно предугадать, какой флокулянт будет предпочтителен. Так, осаждение положительно заряженных частиц (хлопьев) гидроксидов металлов интенсифицируется добавлением анионных флокулянтов, и др. В практике, однако, чаще всего приходиться встречаться с более сложными случаями, особенно при обработке производственных стоков, и использование предполагаемого флокулянта часто не дает ожидаемого эффекта, а иногда и противопоказано.[ ...]
В характерных для биосферы условиях свинец представлен соединениями со степенями окисления свинца + 2 и + 4 (оксид РЬО и диоксид свинца РЬ02). Более устойчивы и распространены в природе соединения РЬ (И). Наибольшее влияние на состав соединений свинца в почвах могут оказать анионы: СО ОН , Б2 , РО и 80 Попадающий при химическом загрязнении в почву свинец сравнительно легко образует гидроксид при нейтральной или щелочной реакции.[ ...]
Важную роль в процессах геохимической миграции химических элементов играют алюмосиликатные и органические коллоиды, имеющие отрицательный заряд и обладающие значительной способностью к сорбции катионов калия, бария, никеля, кобальта, меди, цинка, магния, золота, вольфрама, аммония, натрия. Коллоиды гидроксидов железа адсорбируют анионы фосфорной кислоты, ванадия, мышьяка. Адсорбционная способность ионов обычно хорошо коррелирует со скоростью выщелачивания. Подвижность химических элементов в зоне гипергенеза (по Перельману) приведена в табл. 43.[ ...]
Количество вымываемых загрязнений зависит от многих факторов. С точки зрения фазового состава осадки сточных вод могут быть охарактеризованы как кристаллическая решетка с растворимыми и полурастворимыми составляющими и порами, заполненными жидкостью. Жидкая фаза осадков содержит осадочные количества тяжелых металлов и растворенные соли в виде анионов 804 , СГ, СО2“ и др. При складировании осадка происходит физико-химическое старение гидроксидов металлов, в результате чего в жидкую фазу переходят десорбированные катионы и анионы, уменьшается значение pH и возрастает солесодержание, способствующее снижению произведений растворимости гидроксидов. При воздействии на осадок выщелачивающей жидкости растворяются полурастворимые соединения, например гипс, что также приводит к повышению солесодержания жидкой фазы. Если выщелачивающая жидкость содержит ангидриды кислот (серной, угольной, азотной), значение pH также снижается.[ ...]
В ряде случаев для выявления некоторых свойств воды представляет интерес определение гипотетического состава растворенных в ней солей. Методов нахождения их состава может быть несколько, однако для обработки воды целесообразно определить соли, последовательно образующиеся при повышении pH среды. Диаграмму состава таких солей строят следующим образом: на двух параллельных шкалах в последовательности, приведенной на рис. 3.15, откладывают в масштабе значения концентраций катионов и анионов в миллиграмм-эквивалентах на литр, на третьей шкале — концентрации искомых солей, учитывая, что при pH 8,5 заканчивается выделение гидроксидов Ре (III) и Ре (II), при pH 8,5—9 осаждается карбонат кальция, а при pH > 10—10,3 образуется гидроксид магния. На первых двух шкалах диаграммы катионы расположены в порядке возрастания основных свойств, а анионы — в порядке возрастания кислотных свойств.[ ...]
Выбор реагентов для регенерации ионообменных смол в большой мере обусловлен возможностью использования отработанных регенерационных растворов. Так для регенерации катионитовых фильтров, насыщенных ионами №+, на хлорных заводах может быть использована соляная кислота, являющаяся побочным продуктом обезвреживания газовых выбросов, а полученные растворы хлорида натрия направлены в производство хлора и щелочи. На ряде химических предприятий, а также на предприятиях по производству сульфатной целлюлозы, наиболее целесообразно регенерацию Н+-катионитовых фильтров II ступени осуществлять серной кислотой, а регенерацию анионитовых фильтров I ступени, насыщенных сульфатами, производить щелочью, получая при этом из отработанных растворов сульфат натрия, используемый в производстве целлюлозы, стекла, красителей и других продуктов.[ ...]
Выход металла по току определяется минеральным составом воды. В присутствии иона С1 в зависимости от его количества выход алюминия по току может превышать 100%. Ионы SO 4 и НСОГ замедляют анодное растворение алюминия. Ионы SO4“ уменьшают активирующее действие ионов С1 . При наличии сульфат-гидрокарбонат- и гидрокар-бонат-сульфат-ионов в растворе наряду со снижением выхода алюминия по току происходит рост напряжения на электродах. Наличие SO4--ионов в воде вызывает пассивацию алюминиевого анода, что приводит к постепенному снижению силы тока и выхода алюминия. Интенсивное растворение алюминиевого анода протекает при содержании в растворе до 20 % хлоридов от суммы всех анионов. При этом значительно возрастает содержание алюминия в воде за счет активного химического растворения. Повышенное содержание гидроксида алюминия в воде обеспечивает эффективную очистку воды от загрязнений.[ ...]
