Коррозией называют самопроизвольное разрушение металлов вследствие физико-химического взаимодействия их с окружающей средой. В практике водоснабжения под материалами подразумеваются простые металлы, а также оборудование и изделия, которые изготовлены из этих металлов; средой, в которой происходит коррозия металлов, является вода. Следовательно, процессы коррозии связаны с характерными особенностями воды и металла. Однако коррозию следует отличать от эррозии — поверхностного механического разрушения металлов.[ ...]
Характер и причины коррозии теплообменных аппаратов, трубопроводов и сооружений. Известно, что коррозионный процесс протекает на границе двух фаз: металл — окружающая среда, т. е. является гетерогенным (неоднородным) процессом взаимодействия жидкой или газообразной среды (или их окислительных компонентов) с металлом. Причины и характеры коррозионных процессов весьма разнообразны: атмосферная и почвенная электрохимическая коррозия: электрохимическая коррозия при контакте металлов с разными значениями электрохимического потенциала; химическая коррозия о жидких (высокосернистые нефти) и газовых средах; электрокоррозия объектов, связанных с электроустановками большой мощности; электрохимическая коррозия в растворах кислот, щелочей, мицеллярных растворов; биокоррозия в присутствии продуктов жизнедеятельности сульфатвосстанавливающих бактерий.[ ...]
В практике водоснабжения распространена электрохимическая коррозия, происходящая в присутствии электролитически проводящей среды, при которой ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла.[ ...]
В практике водоснабжения наблюдается и электрокоррозия, или коррозия под действием так называемых блуждающих токов.[ ...]
Нередким случаем в системах оборотного водоснабжения является биологическая коррозия при участии продуктов, выделяемых микроорганизмами биологических обрастастаний.[ ...]
В отдельных случаях происходит коррозия при трении (коррозионная эрозия) — разрушение металла, вызываемое одновременным воздействием коррозионной среды и трением (например, разрушение шейки валков прокатных станков, склазвдаемых морской водой).[ ...]
Сущность электрохимической коррозии состоит в следующем. Если два разных металла поместить в электролит, то создается гальванический элемент. При этом один металл будет анодом, а другой катодом. Анод будет посылать свои атомы в раствор, и разрушаться, а на катоде будут выделяться атомы вытесняемого из раствора элемента.[ ...]
То же будет происходить, если поместить железо в воду. Вода является электролитом, анодом же и катодом будет само железо; вернее, на железе одни участки станут анодом, а другие катодом. Объясняется это тем, что в практике не существует однородных металлов. Некоторая разница в структуре отдельных участков металла, в закалке, наличии окалины, царапины, вмятины и т. Д. приведут к тому, что часть одного н того же материала (например, трубы) станет анодной, а другая — катодной и образуется гальванический элемент. В большинстве случаев это микроэлементы.[ ...]
Посылая свои атомы в воду, железо вытесняет из нее водород, который выделяется на катоде, образуя, окисную пленку. Эта пленка тормозит реакцию и могла бы ее вовсе прекратить, если бы не ряд обстоятельств, которые обычно этому мешают. Наличие окисной пленки на металле сдвигает его потенциал в положительную сторону, следовательно, металл, покрытый окисной пленкой, будет мало разъедаться, пока эта пленка сохраняется, и тем меньше, чем окис-ная пленка плотнее.[ ...]
Кислород сильно увеличивает коррозию металлов в воде. Особенно его присутствие опасно в воде систем оборотного водоснабжения.[ ...]
Рисунки к данной главе:
| Зависимость скорости коррозии (Ск, мм/ год) Стали в воде от температуры °С |
 |
| Зависимость скорости коррозии углеродистой стали от концентрации свободной ушекис ■лоты в воде |
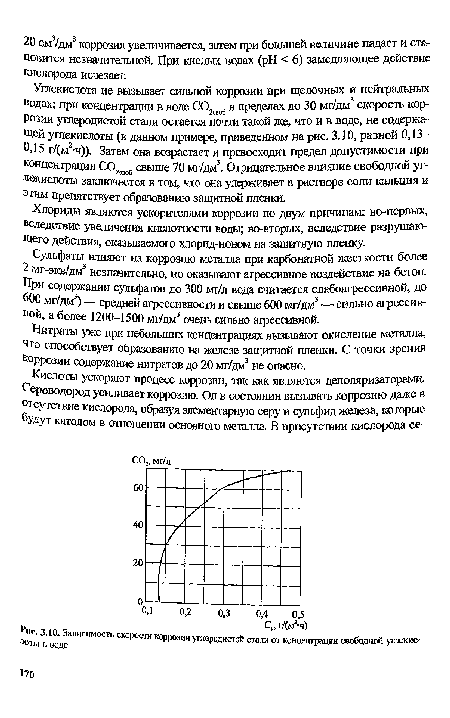 |
| График для определения коэффициента р при стабилизационной обработке воды подщелачиванием (при рНо < рНл < 8,4) |
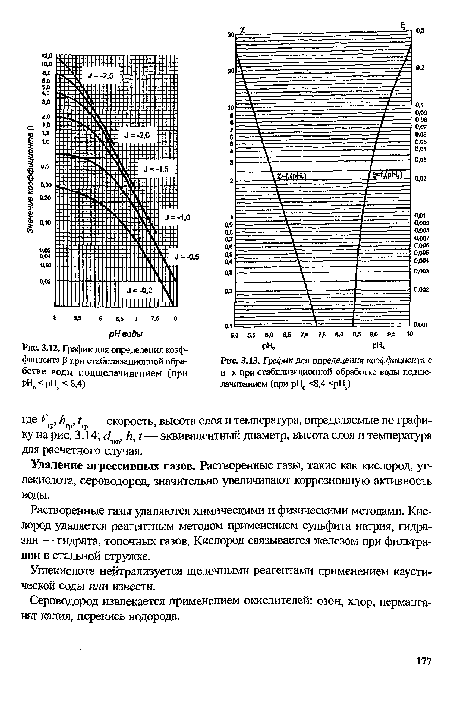 |
| График для определения коэффициента с и х при стабилизационной обработке воды подщелачиванием (при рН0 <8,4 <рН8) |
 |
| График для определения скорости фильтрования |
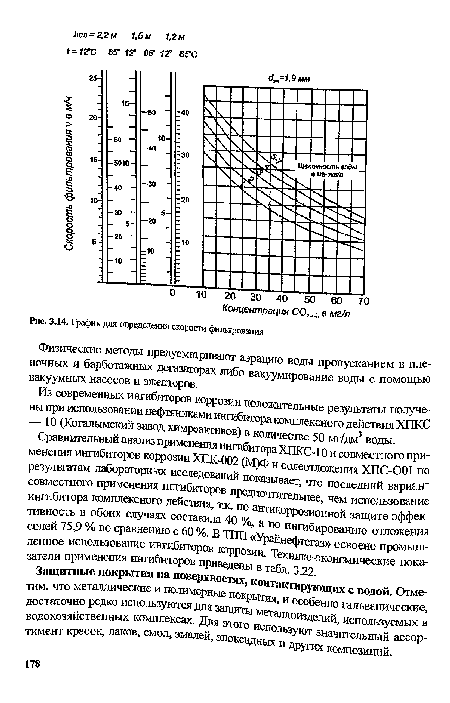 |
| Устройство для растворения и дозирования медного купороса |
 |