В 1914 г. разработан и в 1916 г. в г. Юзовка (ныне Донецк) пущен в эксплуатацию цех азотной кислоты на основе аммиака коксового газа. Разработка велась под руководством русского инженера И.И.Андреева. Сейчас получение азотной кислоты из аммиака - основной способ ее производства.[ ...]
Одновременно с третьей реакцией проводят вторую, так что весь N02 можно превратить в HNO3. Все реакции экзотермические.[ ...]
Исходя из химической схемы (5.24) - (5.26), функциональная схема будет включать подсистемы окисления аммиака, последующее охлаждение газов [реакция (5.24) протекает при высокой температуре], окисление оксида азота и абсорбцию образовавшихся нитрозных газов водой (рис. 5.50). Построение ХТС производства азотной кислоты было рассмотрено в разд. 3.5.2. Здесь остановимся на физико-химическом обосновании отдельных стадий производства.[ ...]
Катализатор - платина или плати нопалладийродиевый сплав (содержание Pt 81-92%). Температура процесса 1100-1200 К. В этих условиях практически не образуется закись азота N20. Из-за обратимости экзотермической реакции (5.25) ее равновесие при температуре окисления аммиака сдвинуто влево, и диоксид азота также отсутствует.[ ...]
Реакция - быстрая, протекает во внешнедиффузионной области. Поскольку скорость лимитируется переносом тепла и вещества между потоком и поверхностью катализатора, то нет необходимости развивать его внутреннюю поверхность, и он представляет собой сетку, сплетенную из металлической проволоки диаметром 0,09 мм. Время контакта составляет (1-т-2)-10-4 с. Аммиак за это время полностью окисляется, так что выход NO совпадает с селективностью реакции по оксиду азота.[ ...]
Полагая ßj = ß2 и стехиометрическое соотношение NH3:02 = = 1:1,25, получим из (5.30) соотношение С]п : С2п = 1:1,25.[ ...]
Во внешнедиффузионной области концентрации исходных веществ на поверхности намного меньше, чем в объеме. У поверхности будет мало как NH3, так и 02. В этих условиях окисление будет протекать в основном до азота. Необходим значительный избыток кислорода у поверхности, чтобы вытеснить с нее аммиак. Тогда его окисление будет более глубоким - до NO.[ ...]
Рисунки к данной главе:
| Зависимость выхода оксида азота £]мо от времени контакта т при окислении аммиака при давлениях 0,1 МПа (/) и 0,7 МПа (2) |
![Зависимость выхода оксида азота £]мо от времени контакта т при окислении аммиака при давлениях 0,1 МПа (/) и 0,7 МПа (2)](/static/pngsmall/255285812.png) |
| Влияние соотношения 02^Н3 на выход оксида азота Е^о в окислении аммиака |
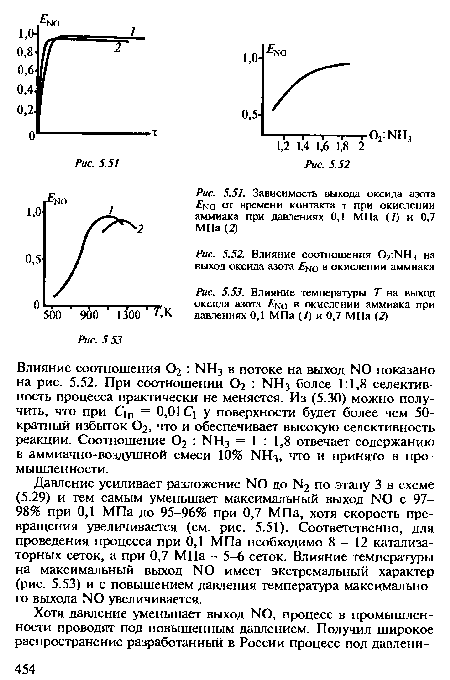 |
| Влияние температуры Т на выход оксида азота Е^о в окислении аммиака при давлениях 0,1 МПа (/) и 0,7 МПа (2) |
 |
| Схема получения азотной кислоты под единым давлением (д) и при двух давлениях (б) |
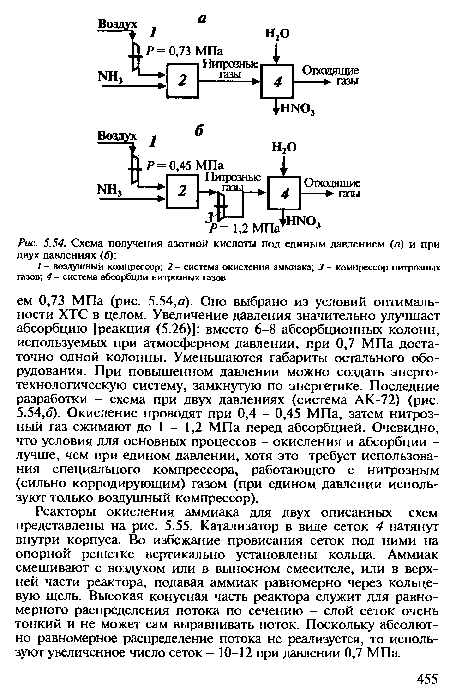 |
| Реакторы окисления аммиака в системах под единым давлением 0,73 МПа (а) и при двух давлениях - система АК-72 (б) |
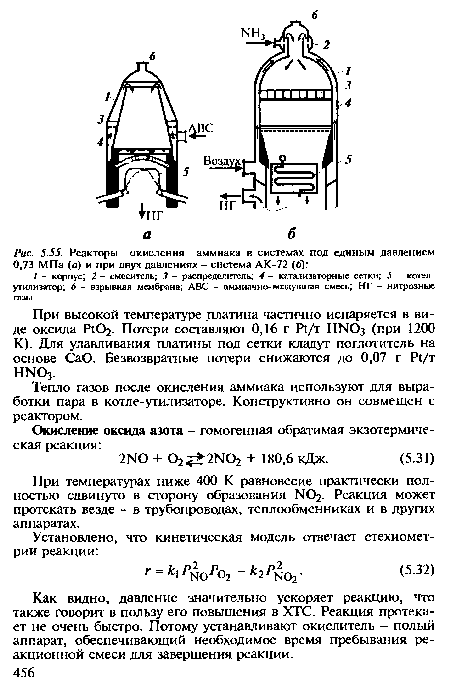 |