Азот широко распространен в природе, он является одним из основных элементов белковых тел - животных и растений. В основном он находится в атмосфере в виде свободных молекул. Подсчитано, что над 1 га поверхности Земли находится около 80 тыс. т азота. Но растения не могут непосредственно усваивать атмосферный азот. Для их питания необходимы неорганические соединения, растворимые в воде или в слабых кислотах. Минеральное сырье очень ограниченно используется для производства азотных удобрений. Главным сырьевым источником остается азот атмосферы. Перевод азота из свободного (молекулярного) состояния в химически связанную форму определил название области химической технологии - “производство (или технология) связанного азота”.[ ...]
Полная, или статическая, сероемкость промышленного поглотителя при 670 К составляет 28% от его массы. Поглощение серы пористым зерном происходит послойно (рис. 5.41,а) и описывается моделью “с невзаимодействующим ядром” процесса “газ-твердое”. Абсорбер - однослойный реактор с неподвижным слоем зернистого поглотителя. Зона реакции (сорбции) занимает только часть высоты слоя, которая продвигается по слою по мере насыщения сорбента серой (рис. 5.41,6). Когда концентрация на выходе превышает допустимую (примерно через 2-3 месяца), поток переключают на другой абсорбер, а отработанный поглотитель заменяют свежим. Поскольку при этом не весь сорбент насыщен (ненасыщенная часть заштрихована на рисунке), то фактическая, или динамическая, сероемкость составляет 15 - 18%.[ ...]
Первая из них - эндотермическая, вторая - экзотермическая. Температура будет по-разному влиять на их равновесие: благоприятно - для первой и отрицательно - для второй реакций. Поскольку сначала надо обеспечить наиболее полное превращение метана, то температуру процесса целесообразно повышать. При этом равновесие второй реакции сдвигается влево. Конверсия метана протекает с увеличением объема, а потому низкое давление будет способствовать более полному превращению метана.[ ...]
Затраты энергии пропорциональны объему газа - числу молей п. При полном превращении метана и СО образуется 4 моля водорода, к которым добавляется стехиометрическое количество азота - 4/3 моля. Если конверсию метана провести при термодинамически выгодных условиях, при атмосферном давлении, то в дальнейшем необходимо сжать более пяти объемов азотоводородной смеси. Энергетические затраты будут меньше, если конверсию провести при промежуточном давлении, сжимая только метан (водяной пар поступает под давлением). Тогда существенно уменьшится энергия сжатия пятикратного объема азотоводородной смеси. Детальные техноэкономические расчеты показали, что на стадии конверсии оптимальным будет давление 4 МПа.[ ...]
Влияние давления на равновесие конверсии метана представлено в табл. 5.4.[ ...]
Теперь рассмотрим аппаратурно-технологическую реализацию выбранных условий конверсии метана. Как следует из равновесных данных, необходима высокая температура процесса. Катализатор в этих условиях весьма активен, и равновесие достигается быстро. Поэтому достигаемое в реакторе превращение можно с достаточной точностью определить из равновесных данных. Конверсия метана - реакция эндотермическая: тепловой эффект взаимодействия метана с водой по уравнению (5.12) О) =-206,4 кДж/моль и превалирует над экзотермическим эффектом другого этапа [см. уравнение (5.13)] (?2 =+41,0 кДж/моль. Необходимое тепло можно подвести через стенки обогреваемых труб, в которых находится катализатор и протекает реакция, т, е. осуществить процесс в трубчатом реакторе, или, как его называют, трубчатой печи. Обогрев осуществляется сжиганием природного газа в факельных инжекционных горелках, расположенных в верхней части межтрубного пространства. Дымовые газы с температурой 1200-1300 К отводятся из нижней части реактора. Температура, необходимая для полного превращения метана, - 1300 К, а металл, из которого сделаны трубки, допускает нагрев не выше 1180-1200 К. Максимальная температура в слое (на выходе) будет, естественно, ниже: 1080-1100 К. Превращение метана не превышает 75% (см. табл. 5.4).[ ...]
Содержание водяного пара в газе - 35-39%.[ ...]
Рисунки к данной главе:
| Использование аммиака в промышленности |
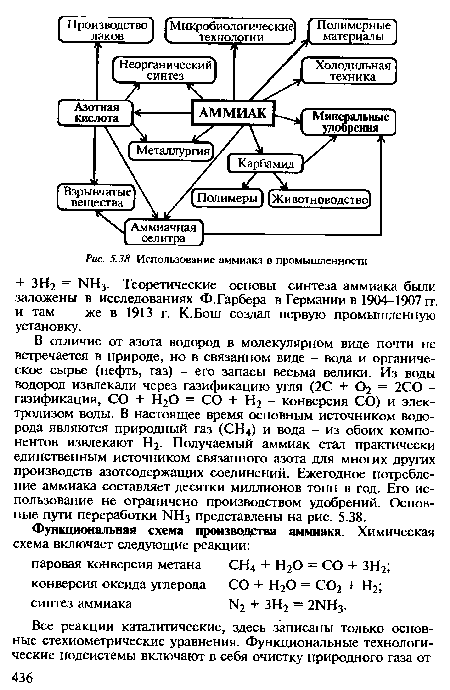 |
| Поглощение сероводорода оксидом цинка |
 |
| Технологическая схема конверсии метана |
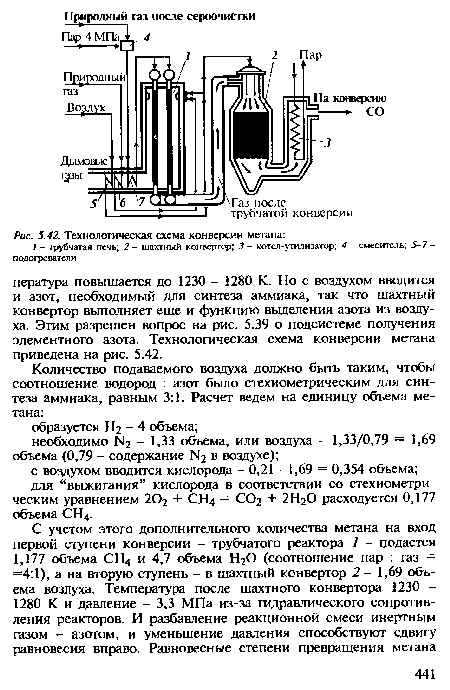 |
| Технологическая схема конверсии СО и диаграмма “ Т-х” |
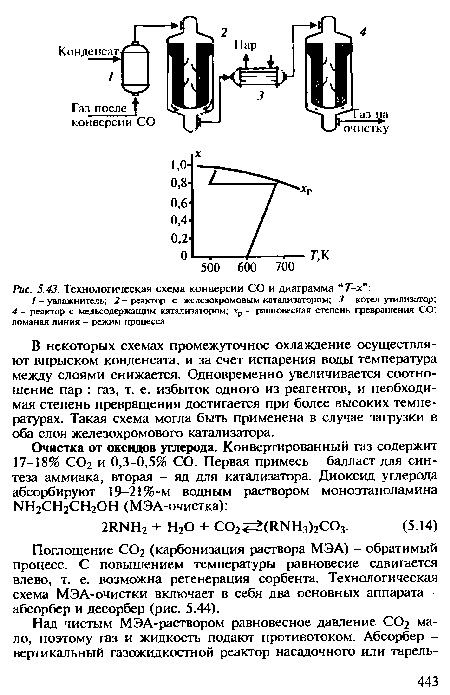 |
| Циркуляционная схема для расчета отдувки |
 |
| Схемы реакторов синтеза аммиака и профили температур в них |
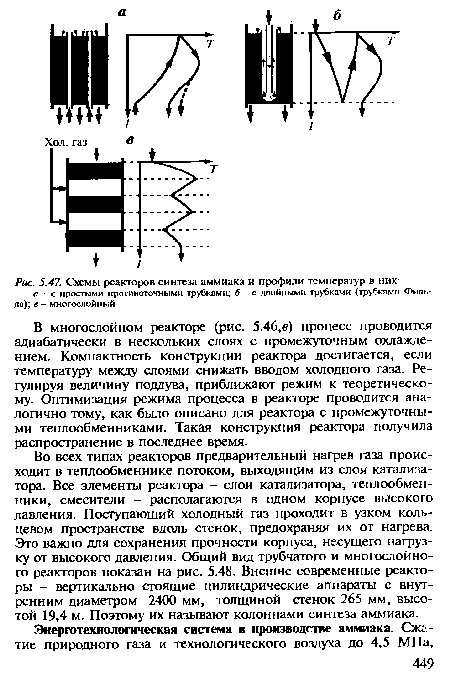 |
| Общий вид реакторов синтеза аммиака |
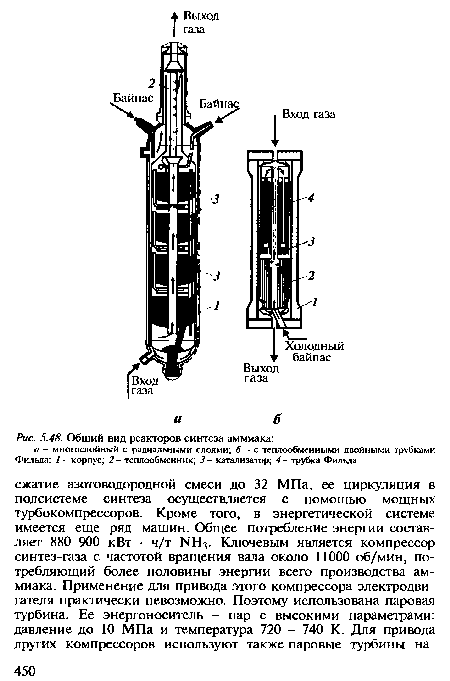 |
Аналогичные главы в дргуих документах:
| См. далее:Производство аммиака |