Зависимость г(х) изображена на рис. 2.14, б. Порядок реакции п изменяет темп возрастания скорости с концентрацией -он выше для реакции более высокого порядка.[ ...]
Константа скорости к зависит от температуры по уравнению Аррениуса (2.39). Характер изменения г(7) будет таким же, как и к (7) (рис. 2.15, а). Для двух реакций с различными энергиями активации Е и ¿2 скорость возрастает с температурой больше у той реакции, у которой энергия активации больше (на рис. 2.15, а Е > £2)- Увеличение температуры изменит зависимости г (С) и г(х). Концентрационная (рис. 2.15, б) и конверсионная (рис.[ ...]
Из (2.44) также следует, что характер влияния начальной концентрации Со на зависимость г (х) будет таким же, как влияние температуры: увеличение Со приведет к возрастанию скорости при той же степени превращения.[ ...]
Рост температуры обусловливает интенсификацию процесса (увеличение скорости) для необратимой реакции. Если необходимо достичь максимальной интенсивности (будем называть эти условия оптимальными), то температура должна быть максимально возможной, допустимой для данной реакционной системы, при любых концентрациях (степени превращения). Ограничение на температуру обусловлено появлением нежелательных реакций, возможностью самовоспламенения, устойчивостью материала аппаратуры и т. д.[ ...]
Поскольку скорость реакции зависит от концентраций двух компонентов, то зависимость г(Сд) будет представлена серией кривых, полученных при разных значениях Сд (рис. 2.16, а).[ ...]
Ск. Если СА < Сд, то скорость становится отрицательной (пунктир на рис. 2.16, а) - реакция протекает в обратном направлении.[ ...]
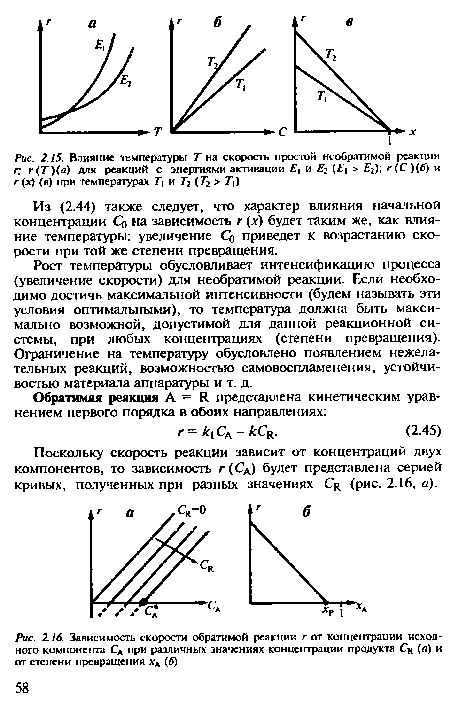
От температуры Т зависят две константы в кинетическом уравнении - к и к2. Обе константы увеличиваются с ростом температуры, но их влияние на г противоположно: увеличение к ускоряет реакцию, а к2 - замедляет. Их совместное влияние зависит от того, какая из констант быстрее увеличивается с температурой, от соотношения энергий активации прямой и обратной реакций. Последнее различно для экзо- и эндотермической реакции.[ ...]
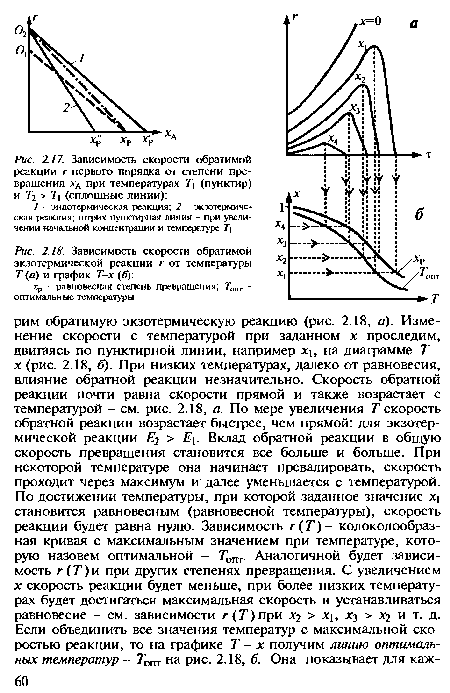
Зависимость г (х) - убывающая линия между г = к Сд 0 при х = 0 и г = 0 при равновесной степени превращения хр. С увеличением температуры начальная (при х = 0) скорость увеличивается. Равновесие изменится в зависимости от того, какая протекает реакция - экзо- или эндотермическая. В эндотермической Хр возрастает, и скорость реакции возрастет во всем интервале изменения х от х = 0 до х = хр (кривая / на рис. 2.17). Равновесие в экзотермической реакции сдвигается влево. Увеличение температуры приведет к увеличению скорости реакции при небольших значениях х. Начиная с некоторого значения х скорость реакции станет меньше, несмотря на более высокую температуру (кривая 2 на рис. 2.17).[ ...]
Графики Т - г и Т-х для эндотермической реакции показаны на рис. 2.19. Реакция будет протекать в прямом направлении, если х < хр, что соответствует области х - Т ниже кривой хр(7’)на рис. 2.19, 6. Для каждого значения х есть температура, при которой реакционная смесь равновесна и г = 0. Начиная от этой равновесной температуры зависимость г (Т) - возрастающая кривая. Оптимальная температура обратимой эндотермической реакции равна максимально допустимой, как для необратимых реакций.[ ...]
Рисунки к данной главе:
| Зависимость скорости простой необратимой реакции гот концентрации С (а) и степени превращения х (6) исходного реагента; п - порядок реакции |
 |
| Зависимость скорости обратимой реакции г от концентрации исходного компонента СА при различных значениях концентрации продукта (а) и от степени превращения хА (6) |
 |
| Зависимость скорости обратимой экзотермической реакции г от температуры Т (а) и график Т-х (6) |
 |