Термодинамическая возможность протекания реакции не означает, что она обязательно должна протекать. Это зависит от скорости реак- 20 / ции. Но условия, определяющие А принципиальную невозможность ее 40- / протекания, гарантируют, что реакция протекать не будет.[ ...]
Далее будем использовать величину С?р как более соответствующую смысловому содержанию: если реакция экзотермическая, то тепло выделяется, и 0р > 0.[ ...]
Равновесие. Одни из первых количественных расчетов в химической технологии были термодинамические. Они включали определение равновесия химически реагирующих систем: это остается актуальным и сегодня.[ ...]
Концентрации С, в (2.26) - равновесные. Если реагирующая смесь описывается несколькими стехиометрическими уравнениями (сложная реакция), то химическое равновесие в такой смеси будет представлено таким же числом уравнений вида (2.26).[ ...]
Из (2.27) и (2.28) видно, что Кр будет увеличиваться с температурой для эндотермических реакций ((?р < 0) и уменьшаться для экзотермических (£)р > 0) (рис. 2.8).[ ...]
Для неидеальной смеси в (2.26) используют активности вместо концентраций, а в (2.29) - летучести вместо парциальных давлений.[ ...]
Аналогично, парциальные давления только газообразных компонентов были использованы в уравнении (2.23) для расчета энергии Гиббса при определении возможности протекания реакции.[ ...]
Определив далее находят равновесные концентрации всех компонентов. Приведем примеры.[ ...]
Учитывая зависимость Кр(Т) для экзо- и эндотермических реакций (см. рис. 2.8), можно построить зависимость л:р(7) для этих реакций (рис. 2.9). Характер изменения хр в зависимости от температуры будет таким же для любых экзо- и эндотермических реакций соответственно.[ ...]
Знак “+” или выбирается так, чтобы значение хр имело физический смысл (0 < хр< 1). В данном случае - знак “минус”.[ ...]
Рисунки к данной главе:
| Изменение константы равновесия с температурой Тдля экзотермической (/) и эндотермической (2) реакций |
 |
| Изменение равновесной степени превращения Хр с температурой Т для обратимых экзотермической (/) и эндотермической (2) реакций |
 |
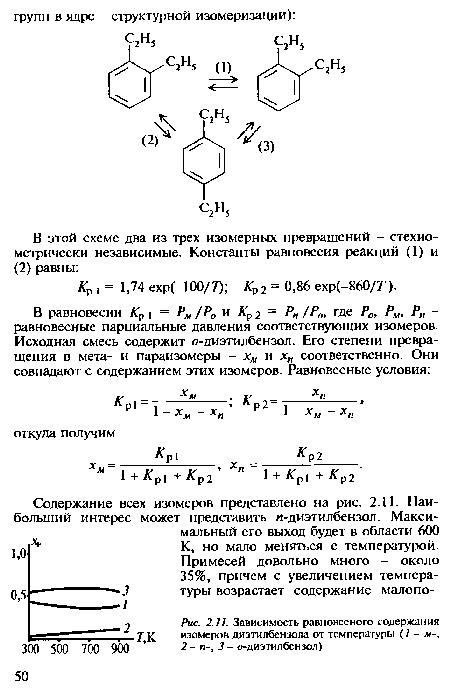
| Зависимость равновесного содержания изомеров диэтилбензола от температуры (1-м-, 2- п-, 3- о-диэтилбензол) |
 |