Окисленная форма вещества с большим потенциалом является окислителем для восстановленных форм с более низким потенциалом, и наоборот, восстановленная форма вещества является восстановителем для окисленных форм с более высоким окислительным потенциалом.[ ...]
Например, молекулярный кислород в кислой среде имеет потенциал £0=1,23 В, следовательно, он может быть окислителем для всех процессов, имеющих меньший окислительно-восстановительный потенциал. Молекулярный водород является восстановителем всех окисленных форм вещества с более высокими значениями окислительно-восстановительных потенциалов.[ ...]
Следовательно, на основании электрохимического ряда напряжений можно дать заключение о возможности протекания окислительно-восстановительных процессов в данной системе.[ ...]
Стандартные окислительно-восстановительные потенциалы позволяют определить возможность или невозможность сосуществования тех или других веществ в данной среде; например, в воде в присутствии растворенного кислорода не могут находиться сероводород, сульфиты и другие вещества с меньшими окислительновосстановительными потенциалами.[ ...]
Окислительно-восстановительные потенциалы дают возможность определить изменение энергии при переходе вещества из восстановленного состояния в окисленное и наоборот. Для этого следует величину стандартного окислительно-восстановительного потенциала умножить на величину 23,06, тогда результат получают в ккал/г-экв.[ ...]
Например, при переходе металлического натрия в ионное (окис ленное) состояние запас свободной энергии натрия уменьшится на 2,71x23,06 = 62,49 ккал/г-экв. Следовательно, при восстановлении 1 г-экв натрия должно быть затрачено такое же количество энергии.[ ...]
Из всего многообразия электродов и цепей выделяют в отдельную группу тс электроды (или составленные из них цепи), атомы которых не участвуют в электродных процессах, а служат лишь переносчиком электронов. Эти электроды и образованные из них цепи называются окислительно-восстановительными.[ ...]
Ео — стандартный потенциал для водорода — равен нулю. Показатель степени 2 говорит о том, что в процессе участвуют два электрона.[ ...]
Э. д. с. цепи следует выражать в вольтах по отношению к нормальному водородному электроду. Для определения гНг не существует методов измерения, и эта величина вычисляется по формуле, указанной выше.[ ...]
Рисунки к данной главе:
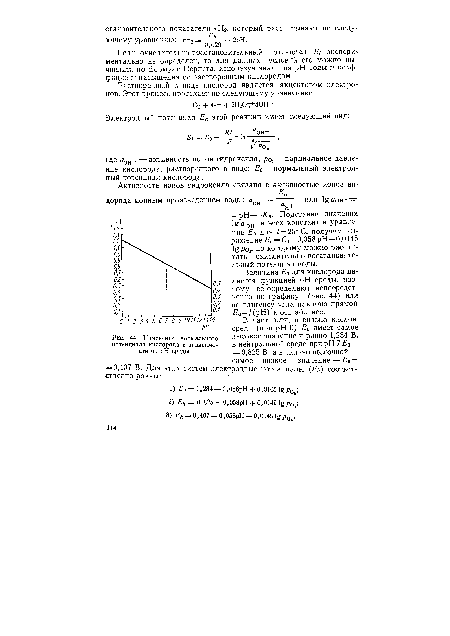
| Изменение нормального потенциала кислорода в зависимости от pH среды |
 |